Periyodik tablo kimyagerler ve diğer bilim adamları için en değerli araçlardan biridir çünkü periyodik sistem kimyasal elementleri en kullanışlı biçimde sıralar. Modern periyodik cetvelin nasıl düzenlendiğini tam anlamıyla anladığımızda, atom sayıları ve sembolleri görmekten çok daha fazlasını yapabiliriz.
Hızlı konu başlıkları
Periyodik cetvel neye göre düzenlendi?
Periyodik Cetvel ve Elementlerin Organizasyonu
Periyodik tablonun dizilimi, elementlerin özelliklerini grafikteki elementlerin pozisyonlarına göre tahmin etmenizi sağlar. Nasıl mı?
Elementler, atom numaralarının sırasına göre listelenmişlerdir. Periyodik cetvel özellikleri için ise birden fazla fikir dile getirilmişti.
Atom numarası, o elementin atomundaki proton sayısıdır. Öyleyse, 1 numaralı element (hidrojen) ilk elementtir. Her hidrojen atomu 1 protona sahiptir. Yeni bir element bulunana kadar, masadaki son element 118 numaralı elementtir. 118 elementinin her atomunun 118 protonu vardır.
Bugünün periyodik tablosu ile Mendeleev’in periyodik sistemi arasındaki en büyük fark budur. Orijinal cetvel, artan atom ağırlığına göre organize edilmiştir.
Periyodik Sistem Özellikleri
Dmitri Mendeleev, element tablosu oluştururken, periyodik sistemin artan atom ağırlığı sırasına göre düzenlendiği kimyasal elementlerin periyodik sınıflandırmasını tasarladı.
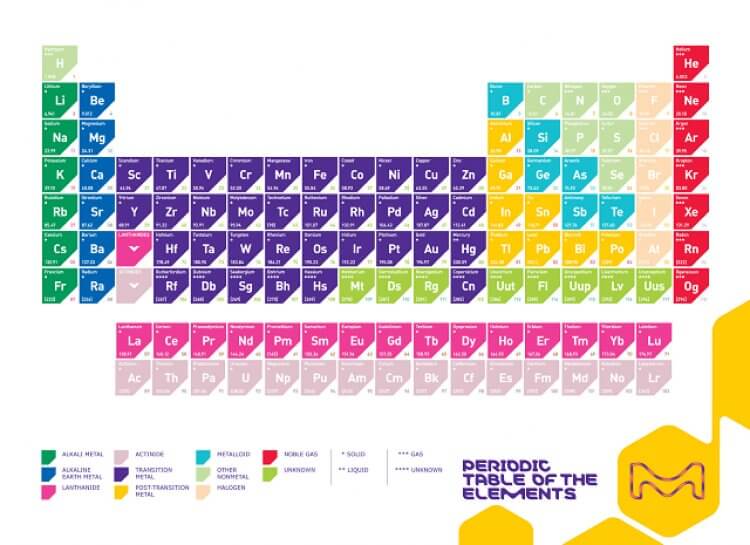
- Periyodik sistemdeki her yatay satıra periyot adı verilir. Periyodik tablo üzerinde yedi periyot vardır. Aynı periyottaki elementlerin tümü, bu düzen boyunca soldan sağa doğru hareket ettiğinizde, elektronların metalik özelliklerden metalik olmayan özelliklere doğru geçişini sağlayan elektron temel durum enerji seviyesine sahiptir.
- Periyodik sistemdeki her dikey sütuna grup adı verilir. 18 gruptan birine ait elemanlar birbirlerine benzer özellikleri paylaşır. Bir grup içindeki her bir elementin atomları, en dıştaki elektron kabuklarında aynı sayıda elektrona sahiptir. Örneğin, halojen grubunun elemanlarının tümü -1 değerine sahiptir ve oldukça reaktiftir.
- Periyodik cetvelin ana gövdesinin altında bulunan iki element satırı vardır. Bu elementler oraya yerleştirilirler, çünkü, olmaları uygun olması gereken yer yoktu. Bu element sıraları ise lantanitler ve aktinitlerdir ki bunlar özel geçiş metalleridir. Üst sıra 6. periyota aitken , alt sıra 7. periyota aittir.
- Her elementin periyodik tabloda kendi karosu veya hücresi vardır. Element için verilen kesin bilgiler değişkenlik gösterir, ancak her zaman atom numarası, elementin simgesi ve atom ağırlığı bu hücrelerde vardır. Element sembolü, bir büyük harf veya başka bir büyük harf ve bir küçük harf olan kısa bir gösterimidir. Bunun istisnası, periyodik tablonun sonundaki, yer tutucu isimleri (resmi olarak keşfedilene ve isimlendirilinceye kadar) ve üç harfli sembolleri olan unsurlardır.
İki ana eleman tipi vardır; metal ve ametal.
Metaller ve ametaller arasında ara özelliklere sahip elemanlar da vardır. Bu elemanlara metaloid veya yarımetal denir. Metal olan element gruplarının örnekleri arasında alkali metaller, toprak alkali metaller, bazik metaller ve geçiş metalleri bulunur. Ametal olmayan element gruplarının örnekleri, ametaller (elbette), halojenler ve soy gazlardır.
Periyodik Sistem ve Konum Tahmini
Belirli bir element hakkında hiçbir şey bilmiyor olsak bile, periyodik tablodaki konumuna ve size tanıdık gelen elementlerle olan ilişkisine dayanarak bununla ilgili tahminlerde bulunabiliriz. Örneğin, osmiyum (Os) elementi hakkında hiçbir şey bilmiyor olabiliriz, ancak periyodik tablodaki yerine bakarsak, demir ile aynı grupta (sütun) bulunduğunu görürüz. Bu, iki elementin bazı ortak özellikleri paylaştığı anlamına gelir. Bildiğimiz gibi demir yoğun, sert bir metaldir. Buradan yola çıkarak Osmiyumun da yoğun ve sert bir metal olduğunu tahmin: edebiliriz.
Dinamik Periyodik Tablo
Eğilimler
Elementler benzer elektronik yapıya göre gruplandırılmıştır, gruptaki elementlerin atom yarıçapı gibi özellikleri de nitelendirilir, bu da tekrarlayan element özelliklerini periyodik tablodaki hali hazırda belirgin hale getirir.
–Elektronegatiflik: Bir atomun bağ elektronlarına sahip çıkma isteğine elektronegatiflik denir. Genel olarak, elektronegativite soldan sağa doğru artar ve bir grupta aşağı indikçe azalır. Elektronegatiflik değerleri arasındaki fark büyüdükçe, iki atomun kimyasal bir bağ oluşturması daha olasıdır.
–İyonlaşma enerjisi: İyonlaşma enerjisi, bir elektronu gaz halindeki bir atomdan uzaklaştırmak için gereken en küçük enerji miktarıdır. İyonlaşma enerjisi bir sıra boyunca (soldan sağa) hareket edildikçe artar, çünkü artan proton sayısı elektronları daha güçlü çeker. Bir gruptan aşağıya indiğimizde (yukarıdan aşağıya), bir elektron kabuğu daha eklendiğinden, en dıştaki elektronu atom çekirdeğinden uzağa hareket ettirerek iyonlaşma enerjisini azaltır.
–Atomik Yarıçap ve İyonik Yarıçap: Atomik yarıçap, çekirdekten en dıştaki kararlı elektrona kadar olan mesafedir; iyonik yarıçap ise birbirine temas eden iki atom çekirdeği arasındaki mesafenin yarısı kadardır. Bu ilgili değerler periyodik cetveldeki aynı eğilimi göstermektedir.
Periyodik cetvelde aşağı doğru hareket ettikçe, elementler daha fazla protona sahip olur ve elektron enerji kabuğu kazanır, bu sayede atomlar daha büyük hale gelir. Periyodik tablonun bir sırası boyunca ilerlerken, daha fazla proton ve elektron olmasına rağmen elektronlar çekirdeğe daha yakın tutulur, böylece atomun toplam boyutu düşer.
–Metalik Karakter: Periyodik sistemdeki elementlerin çoğu metaldir, yani metalik karakter gösterirler. Metallerin özellikleri metalik parlaklık, yüksek elektriksel ve termal iletkenlik, dövülebilirlik ve diğer bazı özellikleri içerir. Periyodik sistemin sağ tarafı, bu özellikleri göstermeyen yani metal olmayanları içerir. Diğer özelliklerde olduğu gibi, metalik karakter değerlik elektronlarının konfigürasyonuyla ilgilidir.
–Elektron ilgisi: Elektron ilgisi, bir atomun bir elektronu ne kadar kolay kabul ettiğidir. Elektron ilgisi, grup boyunca yukarıdan aşağı hareket edilince azalır ve periyodik düzenlemenin bir sırası boyunca soldan sağa hareket edince artar. Bir atomun elektron ilgisi için belirtilen değer, bir elektron eklendiğinde kazanılan enerji veya bir elektron, tek yüklü bir anyondan çıkarıldığında kaybolan enerjidir. Bu, dış elektron kabuğunun konfigürasyonuna bağlıdır, bu yüzden bir grup içindeki elemanlar benzer bir ilgiye sahiptir (pozitif veya negatif). Tahmin edebileceğiniz gibi, anyonları oluşturan elementlerin elektronları katyon oluşturanlardan daha az çekmesi olasıdır. Soygaz elemanları sıfıra yakın bir elektron ilgisine sahiptir.