ABD’deki bilim insanları yakın zamanda, insan embriyolarının genomlarını değiştirmek için moleküler düzenleme aracı CRISPR / Cas9’u başarıyla kullandıklarını bildirdi. Gelin, bu yeni genetik bilimini birlikte inceleyelim… CRISPR, insan embriyolarının DNA’sını düzenlemek için kullanılan bir tekniktir. Kelime anlamı olarak, kümelenmiş düzenli aralıklarla kesişen kısa palindromik tekrarlar anlamına gelir.
Hızlı konu başlıkları
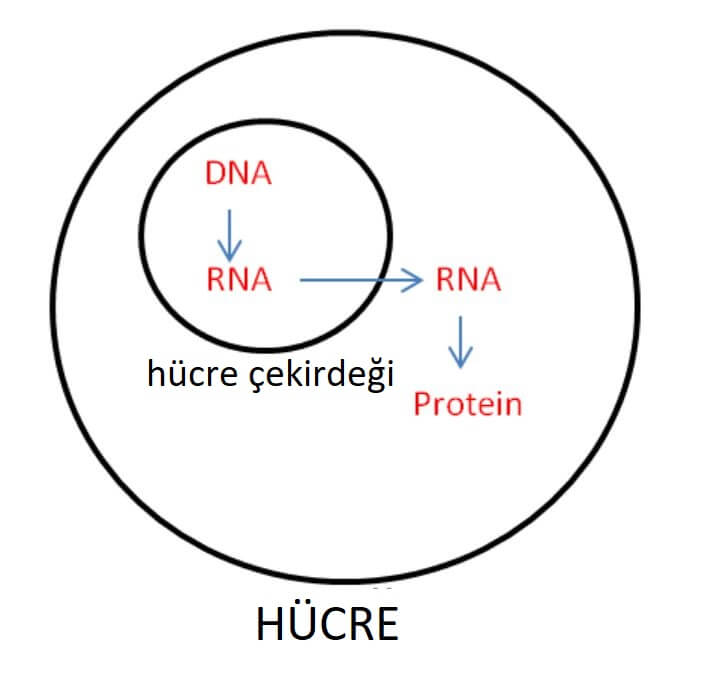
Santral Dogma
Moleküler biyolojideki santral dogma için temel kabulü, işlevsel bir ürün olan bir proteinin yapımı için, DNA’dan RNA’ya doğru gerçekleşen genetik bilgi akışı ile ilgilidir.
Bu karmaşık moleküler komplexte DNA genomu, zarın içine alınmış özel bir nükleusta olan çekirdeğin içinde yerleşmiş halde bulunur. Proteinler çekirdek dışında, ribozom adı verilen organel içinde üretilir. RNA, DNA ile bu organel arasında elçi görevi görür. Aslında mRNA, istenen proteinin üretimi için, sağ amino asiti, yani “iplikleri” bir araya getirmek için ribozom tarafından okunan “örgü modelinin” bir kopyasıdır.
DNA genomunu, bir hücrenin ana örgü desen koleksiyonu olarak düşünebilirsiniz. Dokumacı, atölyenin etrafındaki tüm bu partiyi taşımak istemiyor, bu yüzden dokuma yapmak istediği tasarımın bir mesajcı RNA’sını kopyalıyor ve sadece bu kopyasını çevirmek için RNA talimatlarını kullandığı dokuma tezgahına taşıyor.
Peki RNA’yı bu kadar özel kılan şey nedir? Bu yapı elbette DNA’ya çok benziyor ama aralarında temel bir fark var. DNA’nın belli bir baz çifti olarak bilinen, tek bir “birim” veya genetik harfin eşdeğer bir RNA biriminden bir tane daha az oksijen atomuna sahip olmasıdır. Omurgalılarda RNA moleküllerinin sadece tek bir gen kodladığı, DNA’nın proteinleri doğrudan kodlamayan “önemsiz” olarak taşıyabileceği gerçeği gibi başka bazı küçük farklılıkları da vardır.
Dikkat edilmesi gereken bir başka nokta, DNA verilen bir gen için bir RNA molekülü oluşturduğu zaman, DNA dizisinin genetik ayna görüntüsü olan bir RNA molekülü yaratmasıdır. Bu, RNA’nın belirli bir DNA sekansıyla eşleştiği ve bununla eşleşebileceği veya “bağlanabileceği” anlamına gelir. Bu, protein üretmek için o kadar önemli değil, ancak bilim insanlarının CRISPR’de avantaj sağladığı önemli bir özelliktir.
Tekrarlanan DNA dizileri CRISPR işlevi için gereklidir
CRISPR, istenilen bir genin DNA dizisini değiştirebilir. Başka bir özelliği de, yeni bir genin fonksiyonel bir protein üretebilmesi için, hatalı bir genin sabitlenmesi için kullanılabilir. İnsan embriyolarının genom düzenlemesindeki amaç, tek bir genin neden olduğu hastalıkları klinik olarak kendini göstermeden önce tedavi etmek. Peki, bu yeni tedavi yöntemini CRISPR nasıl başarıyor?
Genomik bilgi DNA’da, bilim insanlarının tek harflerle atıfta bulundukları dört basit molekülle DNA’da kodlanmıştır: A (Adenin), T (Timin), G (Guanin) ve C (Sitozin). Genel olarak, bu harflere baz çiftleri denir. Her gen, bu dört harften oluşan benzersiz dizilerden oluşur ve ortalama insan geni, 10 ila 15 bin baz çifti uzunluğundadır. Bu kadar uzun bir baz çifti için, 15 bin slotunuzun olduğunu düşündüğümüzde, harflerin (veya gen dizilerinin) gerçekten eşsiz bir sıralamasını nasıl üretebileceğinizi hayal etmek oldukça kolaydır. Fakat DNA dizilerine çok daha küçük bir ölçekte bakmaya başladığınızda olay daha da karmaşıklaşır.
Gen üzerinde sadece üç boşluk olduğunda A, T, G ve C harflerini yazmanın birçok farklı yolu vardır. Ancak, herhangi bir mesajın nasıl kopyalanacağını düşündüğünüzde, bu yapı, daha da karmaşık bir hal alıyor. Bununla birlikte, bunu yapabileceğiniz bir çok farklı yol vardır. Bu da, olası kombinasyon sayısının sınırlı olduğu anlamına gelir. Dolayısıyla, sadece 3 baz çiftindeki DNA dizilerine bakarsanız, aynı deseni veya ‘motif’ i tekrar tekrar görmeye başlayacağınızı hayal edebilirsiniz. Ve çoğu türün genomunda, yüksek frekansta meydana gelen üç harfli bir motif olduğu ortaya çıkmıştır. Buna protospacer komşu motifi denir ve bilim insanları bunu PAM şeklinde kısaltmıştır.
Başlangıçta, bilim insanları PAM alanını ve diğer 3 harf baz çift dizisini görmezden geldiler. Çünkü, onlarla hiçbir şey yapamıyorlardı. Genom boyunca tekrarlandıkları için, bilim insanları onları bir geni tanımlamak için kullanamadılar. Ancak, son zamanlarda, bazı bilim insanları Cas9 adlı bir proteinin PAM alanını tanıyabileceğini keşfetti. Bu noktada, her şey değişti…
Cas9 proteini, PAM alanlarında DNA’yı keser
Cas9, DNA’yı istenilen yerden kesebilen enzim anlamına gelen bir endonükleazdır. Doğru koşullar sağlandığında, Cas9 bir PAM alanı bulduğunda, istenilen yerden DNA’da bir kesme işlemi gerçekleştirir.
Bir hücrenin DNA’sı her zaman kırılgandır. Bu nedenle, türlerin çoğu bu sorunu çözmek için DNA onarım mekanizmaları geliştirmiştir. Ancak, bu mekanizmalar DNA’yı her zaman mükemmel şekilde onarmaz. Bu nedenle, eğer Cas9, DNA’yı iyi bir şekilde keserse, nihayetinde tesadüfen de olsa, değiştirilmiş bir gen dizisini geride bırakabilir.
Bu noktada elimizdeki tek şey, DNA’daki üç harfli bir diziyi tanıyabilen ve istenilen yerde kopmalara neden olan bir proteindir. PAM alanları genom boyunca sıkça görülür. Bir PAM alanını diğerine hedeflemenin bir yolu olmadan, Cas9 işe yaramaz bir araçtır.
Bu, birçok bilim insanının yaptığı dahice bir içgörüdür: Cas9 proteinini spesifik PAM alanlarına hedeflemenin bir yolunu buldular ve bu şekilde CRISPR oluşturdular. Şimdi ise, ilk önce kimin yaptığını ve böylece kimin patent aldığını tartışıyorlar. Bazıları bunun on yılın bilimsel skandalı olduğunu söylüyor!
CRISPR / Cas9 – Nasıl Çalışır?
Bilim insanları tarafından oluşturulan mekanizma, kavramsal olarak oldukça basittir. Bir genin düzenlenebilmesi için, gerekli birçok adım vardır. Öncelikle, düzenlemek istediğiniz bir gene ait PAM alanını bulmanız gerekir. Bunun için, bu alanın yanındaki DNA’ya bakıp bir sonraki 18-21 baz çiftinin benzersiz olduğunu teyit etmelisiniz. Eğer benzersiz değilse, başka bir PAM alan adı aramanız ve işlemi tekrarlamanız gerekir. Eşsiz bir DNA dizisinin hemen yanındaki faydalı bir yerde bir PAM alanınız olduğu zaman sıkı çalışma başlar. PAM alanı ve bitişik DNA dizisi ile tam olarak eşleşen bir RNA parçası sentezlemeniz gerekir. Daha sonra bu RNA molekülünü, Cas9 proteinini bağlayabilen başka bir RNA parçasına bağlamalısınız.
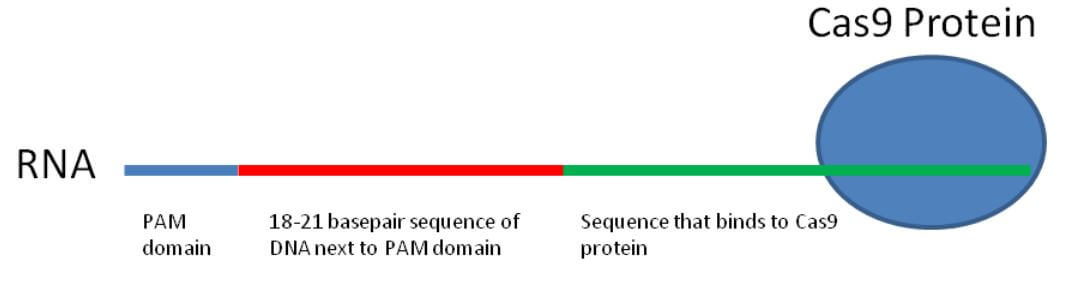
Bu RNA molekülleri kompleksi, neredeyse nihai diplomat gibidir. PAM alanı ve bitişik DNA dizisi ile eşleşen RNA segmenti, genomdaki o istenilen konumda DNA’yı tanıyabilir ve bağlayabilir. RNA süpermolekülünün diğer yarısı burada eşlik eder ve Cas9 proteinini bağlar. Böylece hedef DNA parçası ile etkileşimlerini kolaylaştırır. Daha önce tartıştığımız gibi, Cas9 proteini bir PAM alanı gördüğünde, istenilen yerden DNA’yı keser.
Kesilen DNA sırayla, hücrenin DNA onarım mekanizmalarını harekete geçirir. Bu noktada, bir bilim insanı genom düzenlemede iki yoldan birini seçebilir: Çok doğru fakat verimsiz mekanizma olarak adlandırılan HDR veya daha verimli ama daha az doğru işlem NHEJ.
NHEJ nedir?
NHEJ, homolog olmayan uç birleştirme anlamına gelir. NHEJ, CRISPR kullanırken bilim insanlarının alması en kolay yaklaşımdır. Bilim insanları, CRISPR sistemini bir hücrenin çekirdeğine yerleştiriyor ve temel işlem olarak en iyisinin gerçekleşmesi için umut ediyorlar.
Bu abartı değil. Teori şu ki; Cas9 hedef DNA’sını kesmeye devam ediyor ve tamir mekanizmaları onu sabitlemeye devam ediyor, sonra nihayetinde şans eseri bir şeyler ters gidiyor ve gen kırık kalmaya devam ediyor. Belki de DNA onarım mekanizması yanlış baz çifti ekler, kırık bir gen yaratabilir veya belki de DNA’nın küçük bölümleri yanlışlıkla silinir (INDELS olarak adlandırılır).
DNA tamir makinelerinin yapabileceği daha birçok hata var ve hepsiyle ilgili umut, hedef genin kırılması yönünde. Ancak, tahmin edebileceğiniz gibi, rastgele bir sistemle, bilim insanları, DNA’da CRISPR’ın ne değiştireceği ve bu değişimin faydalı olacağı konusunda hiçbir fikirleri yok. Fakat; eğer bir bilim insanının yapmak istediği şey bir genin kesilmesi ise ve nasıl olacağını umursamıyorsa, NHEJ bu iki sistemin en kolay haliyle gitmenin yoludur. Ayrıca en verimli olanıdır. Ancak; CRISPR, NHEJ verimliliğine dair kesin tahminler vermek zor olsa da, pek çok şey hangi hedefi hedeflediğiniz, hangi türleri kullandığınız, hücre içinde nasıl CRISPR aldığınız ve hangi yöntemi kullanıp kullanmadığınız dahil olmak üzere onu etkiler.
HDR nedir?
Homoloji odaklı onarım veya HDR, CRISPR yaklaşımlarının daha karmaşık olduğu bir sistem. Bilim insanları, değiştirilmiş DNA dizisine ne olacağını kontrol etmek istiyorlarsa HDR kullanırlar. Bu sistemin kullanımı tabii ki çok daha zor.
DNA onarım aşamasına kadar HDR, NHEJ ile aynı şekilde çalışır. Bununla birlikte HDR’de bilim insanları, bir hücrenin DNA onarım mekanizmasını tasarladıkları bir DNA parçasına eklemek için gen parçasını kandırmak istiyorlar.
Bunu, yeni DNA sekanslarını, CRISPR kesim sahasının her iki tarafındaki DNA ile tam olarak eşleşen DNA parçalarıyla sınırlandırarak yaparlar. Orijinal DNA dizisini onarmak yerine, tamir mekanizmasının seçili DNA bitimine, bir sözcük belgesinde kesmek ve yapıştırmak için benzer bir şekilde eklenmesini umuyorlar.
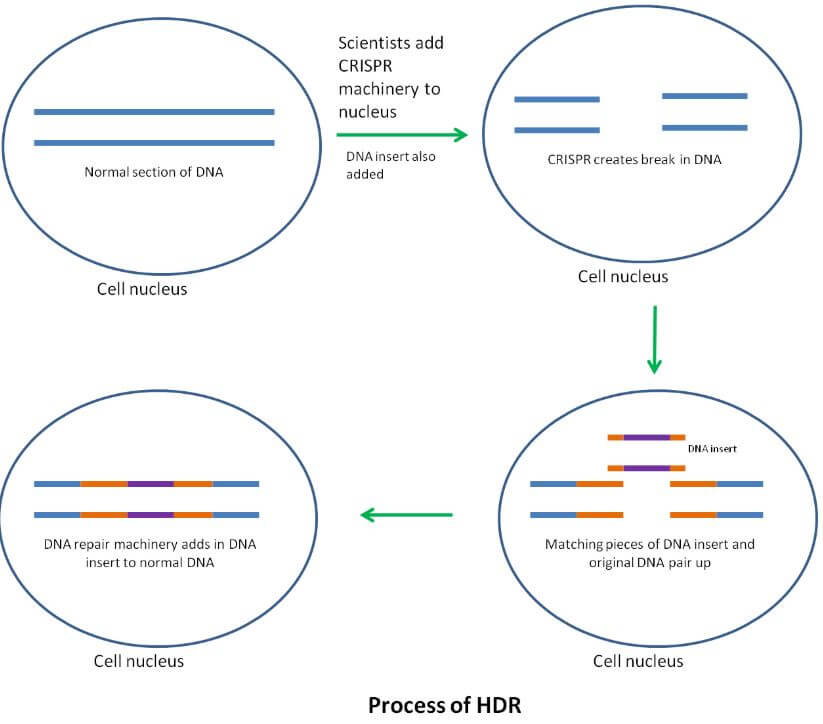
Bu tür bir yöntem, bilim insanları bir genom içine bir şey eklemek istedikleri zaman kullanılması daha çok yararlıdır. Örneğin, bir bilim insanı ne yaptığını incelemek için bir insan genini fareye aktarmak isteyebilir. Bilim insanları bu tekniği, bir genin kırık bir kopyasını, çalışan bir versiyonla değiştirmek için de kullanabilirler. Bu nedenle kalıtsal hastalıklar için yeni tıbbi tedaviler için potansiyele sahiptir. HDR, kırık bir geni çok kesin bir şekilde düzeltmek için bir yol sunar, ancak çok verimsizdir. Bazı bilim insanları, zamanın yüzde 5-23’ü kadar fare embriyolarında çalışabildiler.
Daha az doğru sonuç veren NHEJ, hücrelerdeki doğal DNA onarım mekanizmalarının kendi rastgele hataları nedeniyle ortaya çıktığından, NHEJ ve HDR’nin aynı hücrede gerçekleşmesi teorik olarak mümkündür. Bilim insanlarının bu sorun için laboratuvarda bir çalışma yapması her zaman mümkün değildir. Ama bu her zaman bir sorun teşkil eder mi? Bilim insanları, tek tek hücreleri genetik olarak değiştirdiğinde, bu o kadar da önemli değildir. Ancak; bilim insanları, embriyoların DNA’sını değiştirirken çok büyük bir problemle karşılaşır. Çünkü embriyolar mozaik olabilir.
Mozaik nedir?
İnsanların ve hayvanların büyük çoğunluğu, vücutlarındaki her hücresinde aynı DNA dizilimine sahiptir. Çok küçük bir yüzdelik dilimde, farklı hücrelerde farklı DNA var ve biz onların mozaik olduklarını söylüyoruz.
Mozaik, hayvanlar ve insanlarda doğal olarak meydana gelir. Ancak, onları CRISPR ile yanlışlıkla üretmek mümkündür. CRISPR tipik olarak doğrudan tek hücreli embriyoların çekirdeğine enjekte edilir. Fakat, bu embriyolar sonunda iki hücre olacak, daha sonra bu iki hücre de dörde bölünecek ve böylelikle tam bir organizma ortaya çıkana kadar bölünme devam edecektir.
CRISPR makineleri ilk hücre bölünmesinden sonra takılırsa ne olur?
O zaman her biri birbirinden bağımsız hareket eden iki farklı hücrede CRISPR makineniz olacaktır. NHEJ’in rastgele düzenlenmesi diğerinde değil, bir hücrede tekrar gerçekleştiyse, farklı DNA sekanslarına sahip 2 hücreyle işlem tamamlanır ve eğer bir embriyonun ilk 2 hücresi farklı DNA sekanslarına sahipse, o zaman 2 farklı DNA setiyle bütün bir organizma oluştururlar. İşte bu şekilde mozaik oluşur.
CRISPR ile ilgili tüm kısıtlamalarda olduğu gibi, laboratuvarda hücrelerle çalışırken mozaikçilik büyük bir sorun değildir. Ancak, klinikte büyük bir sorun haline gelir. Bir terapi geliştirirken, genetik bir terapi olsa bile, bilim insanlarının ve doktorların tam olarak ne yaptıklarını bilmeleri gerekir. Mozaik genom düzenlemesinin bazılarının DNA’nın sabitlenmiş, bazılarının DNA’nın olmadığı, bazılarının da DNA’nın sabit olduğu ve daha sonra kırıldığı sonucunu verir.
Her iki senaryoda da, hala bazı kesilmiş DNA hücreleri olan bir hastayla karşılaşırsınız. Ve hangi organların hangi embriyonik hücreden geliştiğini bilmediğimiz için, hasta sağlıklı hücrelerden yapılmış bazı organlara ve kırık hücrelerden yapılmış bazı organlara sahip olacak ve bilim insanları hangisinin olduğu hakkında hiçbir fikre sahip olmayacaklar. Bu bir terapi için harika bir başlangıç değil. Yani, şaşırtıcı olmayan bir şekilde, bilim insanları, mozaik CRISPR hayvanlarının gelişimini sınırlamak için çok çaba sarf ediyorlar.
Hedef dışı kesim
CRISPR’de mozaik hayvanların sorunu yeterince karmaşık görünüyor. Ancak, CRISPR’de, sadece mozaikçilikle ilgili sorunları daha da şiddetlendirmekle kalmayıp, aynı zamanda kendi başına, CRISPR’yi terapötik olarak kullanmak için büyük bir engel teşkil eden son bir karmaşıklık seviyesi vardır. Ben rezil hedef dışı etkilerden bahsediyorum.
Bilim insanları CRISPR kullandıklarında, hedef dışı etkileri mümkün olduğu kadar sınırlamak için kullanılacak genom düzenleme makinelerini tasarlamak için çok zaman harcıyorlar. Ne yazık ki, onlardan tamamen kaçınmak imkansız.
Peki onlar ne? Ve neden önemli?
CRISPR, DNA’yı kesen Cas9 enziminden ve Cas9 enzimini diplomatik olarak doğru DNA baz çiftine getiren RNA süpermolekülünden oluşur.
RNA süpermolekülü, Cas9 enzimine bağlanmasına izin veren bir dizi ve yanındaki önemli PAM alanını ve DNA baz çiftini tanıyan bir dizi içerir.
RNA diplomatının hedeflediği PAM alanının yanındaki DNA baz çifti genellikle 18 – 21 temel ve uzun ve teorik olarak tamamen benzersizdir.
Sorun, insan genomunun, bu temellerin yaklaşık 3 milyarını içermesidir. İstatistiksel olarak, 18-21 bir baz çifti dizisinin en az bir kez tekrarlanmayacağı pek olası değildir.
Bu tekrarlanan dizi aynı zamanda nadir görülen bir PAM alanın yanında bulunuyorsa ne olur?
Böyle bir senaryoda ne olduğu pek şaşırtıcı değil: CRISPR makinesi genomdaki her iki alanı bulup keser, bu da hedef bölgeyi ve diğer bazı rastgele hedef dışı DNA baz çiftini değiştirdiği anlamına gelir.
En az bir hedef dışı siteyi tanımayan RNA diplomatlarını tasarlamak neredeyse imkansız. Ancak, etkilerini en aza indirmeyi deneyebilirsiniz.
Hedef dışı bölge, farklı bir proteini kodlayan bir gen içerisinde meydana gelirse, o zaman başınız büyük belaya girebilir. Eğer CRISPR, tesadüfen, o geni kırarsa bir hastalığa neden olabilir. Örneğin, hem anneden hem de babadan aldığınız CFTR gen kopyaları kırılmışsa, maalesef Kistik Fibrozis adı verilen kötü bir hastalığınız olur.
Bu yüzden bilim insanları, genellikle, hedef dışı bölgelerin diğer proteinler içinde bulunmadığı RNA süper moleküllerini tasarlamaya çalışır. Teori, bir proteini kodlamayan bir DNA parçasının kırılması durumunda bir hastalığa neden olma olasılığının düşük olması ve bu kadar büyük bir olay olmamasıdır.
Bununla birlikte, başlangıçta önemsiz DNA olarak adlandırılan, proteinler üretmeyen DNA’nın, aslında, bazı önemli fizyolojik roller oynadığı açıkça görülüyor. Gerçekten işe yaramaz olan hiçbir DNA yoktur.
Önemsiz DNA denilen karmaşayı bertaraf ederken, genlerin zarar vereceği şekilde hastalıklar üretmeyebilir, evrimsel olarak daha az uygun olan bir organizma üretebilir. Orada olması gereken her şey orada olacak ve işe yarayacak … Ama olabileceği kadar iyi çalışmayabilir. Belki de bu, metabolizmanın olabileceğinden daha yavaş olduğu anlamına gelecektir.
Hedef dışı etkilerin üstesinden gelebilir miyiz?
CRISPR’ın hedef dışı kesilmesinin ne kadar sorunlu olabileceği göz önüne alındığında, bilim insanlarının bu riski mümkün olduğu kadar sınırlandırmaya çalışması şaşırtıcı değildir.
Bilim insanları, CRISPR’ı sadece düzenlemek istedikleri genleri, türlerin tam genomik sırasını bildiklerinde kullanabilirler. Bütün genom dizisi bilinemediği için, bilim insanları, mümkün olan en az hedef dışı alanlara sahip RNA süpermoleküllerini hesaplayarak bulabilirler.
Fakat tabiat ana hala kollarında birkaç numaraya sahip. Bazı bilim insanları, bu hedef dışı tahmin yönteminin, hücrelerde ne kadar doğru olduğunu araştırdılar. CRISPR’ın her zaman beklenmedik yerlerde kesildiğini fark ettiler.
Bu, algoritmaların hatası gibi görünmüyor. Bunun yerine, RNA üst molekülü, Cas9’u DNA’ya getirmek için çok istekli, bazen yanlış DNA parçalarını yanlışlıkla tanıyor. İlginç bir şekilde, bunu tutarlı bir şekilde yapıyor gibi görünüyor. Bu durum, bilim insanlarının hala araştırdığı bir şey.
Böylece hedef dışı kesmenin gerçekleşeceğini ve potansiyel olarak oldukça ciddi sonuçları olacağını biliyoruz. Ancak, bu gerçekten çok büyük bir sorun mu? Kesinlikle bilim insanları CRISPR ile ilgili yutturmaca verildiğinde bir çözüm buldular, değil mi?
Laboratuvarda çalışmak çok daha kolaydır. Genetik olarak kemirgenleri düzenliyorsanız, bilim insanları düzenlenen hayvanları geriye çapraz olarak kullanarak hedef dışı etkilerin üstesinden gelebilirler.
Geri dönüş, yeni bir fikir değildir. Bilim insanları ve hatta köpek sahipleri veya atları besleyen insanlar, yüzyıllar boyunca (birçok farklı isimle geçmesine rağmen) bu işlemi yapıyorlardı.
Bilim insanları, böylece, nesiller boyunca genetiği değiştirilmiş geni bir kemirgen türünden diğerine taşıyabilir. Bunu yeterli sayıda nesiller için yaparlarsa, sonunda tüm hedef dışı etkiler kaybolacak ve normal bir DNA ve bir düzenlenmiş gene sahip olan bir fare suşu yaratacaktır.
Bunu insanlarda yapamayız. Aslında, CRISPR ile insan embriyosunu düzenlemek için en büyük endişe, embriyodaki bazı hücrelerin germline haline gelmesidir. Bunlar, yumurta veya sperm şeklinde gelişecek ve böylece değiştirilmiş genleri gelecek nesillere aktaracak hücrelerdir. Sabit bir gene yeni nesile geçmek o kadar da kötü değil, tam olarak tahmin edemediğimiz hedef dışı değişiklikler yapmak oldukça korkutucu.
Bilim insanları, CRISPR’ı kullanmanın bir yolunu geliştirene ve hedef dışı etki olmayacağını garanti edene kadar, tekniğin oluşturduğu tasarımcı bebeklerin etik tartışmalarına bakılmaksızın, insan embriyolarını düzenlemek için kullanılması olası değildir.
Öyleyse bilim insanları neden CRISPR konusunda heyecanlılar?
Tüm CRISPR kısıtlamaları ile, tüm yutturmaca hakkında ne olduğunu merak ediyor olabilirsiniz. CRISPR hala sahip olduğumuz en güçlü genom düzenleme aracıdır. Ancak, mevcut haliyle, insan embriyolarını terapötik olarak düzenlemek için kullanılması muhtemel değildir.
CRISPR özeldir. Çünkü, tüm PAM alanları nedeniyle çok fazla potansiyel hedefi vardır. Ayrıca, bilim insanlarının sıralı bir genomları olduğu sürece, yeni organizmaların genomlarını düzenlemelerine izin veriyor. Aynı zamanda, nispeten ucuz ve hızlı. Daha önceki teknikler, tek bir mutant fare üretmek için 18 – 24 ay gerekir. Şimdi, teorik olarak, tek bir enjeksiyonla yapabilirsiniz.
CRISPR bu nedenle temel araştırma için son derece güçlü bir araçtır. Ayrıca, insanlarda bazı potansiyel terapötik uygulamalara da sahiptir.
Tek bir genin neden olduğu genetik hastalıkları olan ve Duchenne Musküler Distrofi gibi tek bir organı etkileyen insanlar, CRISPR’nin şu anda klinikte nasıl kullanılabileceğinin güzel bir örneğidir.
Bilim insanları, bir bireyin kas kök hücrelerini alabilir, hatalı geni CRISPR ile onarabilir ve değiştirilmiş hücreleri hastaya tedavi olarak geri verebilir. Bu tür bir yaklaşım, diğer genom düzenleme teknikleri kullanılabilmesine rağmen, gen terapisinin teorik temelidir.
CRISPR’ın klinikte nasıl çalışabileceğine bir başka örnek ise, hastanın bağışıklık hücrelerini almak ve genomlarını CRISPR ile düzenlemek, yani kanser tedavisi hedeflenmektedir.
CRISPR’nin, insan embriyolarını düzenlemeden terapötik olarak nasıl kullanılabileceğine dair daha pek çok (teorik) örnek vardır. Bu yaklaşımlarda hedef dışı etki ve mozaikçilik sorunları daha az önemlidir. Çünkü, bilim insanları sadece bir hücre tipini değiştirir ve bu değiştirilmiş hücreler bir sonraki nesil tarafından asla miras alınmaz.
Sınırlamalarına rağmen, CRISPR biraz yutturmaca yaşıyor, temel bilimsel araştırmalarda devrim yarattı ve gerçekleşmesini bekleyen bir dizi tıbbi buluşu destekleyebilir.